简介
由于COVID-19在全球的大流行,mRNA疫苗被推到了生物技术和制药工业的中心舞台。由BioNTech/辉瑞、Moderna、CureVac、Sanofi/TranslateBio、Arcturus/Duke-NUS新加坡医学院、伦敦帝国理工学院、泰国朱拉隆功大学和Providence Therapeutics领导的mRNA疫苗人体试验共有8个正在进行。
值得注意的是,其中两项试验已经公布了3期临床中期结果,报告了接种2次30 μg或100 μg剂量LNP包裹的编码刺突蛋白免疫原的mRNA序列后,病毒感ran率降低94%以上。疫苗开发的速度也远超出了预期,在SARS-CoV-2序列*公开后10个月就有了如此**的效果。这一成功不*证明了生物技术和制药业有应对紧急和紧缺的全球性需求的能力,也证明了mRNA作为一种药物的所具有的能力,在中mRNA作为一种预防性疫苗。本综述的目的是概述mRNA递送系统的发展、总结SARS-CoV-2 mRNA疫苗的临床前和临床发现,并将其与其成功的递送系统特征联系起来。近有几篇早于爆发的关于疫苗和zhi疗mRNA递送系统的的优综述已经发表。
与小分子、DNA、寡核苷酸、病毒系统和蛋白质,包括抗体等的其他药物形式相比,mRNA疗法具有许多优势和几个难点。与寡核苷酸和大多数小分子药物有限的靶点相比,mRNA可以调节刺激和抑制作用方式,也能够表达或替换缺陷蛋白,这扩大了其使用的潜在适应症范围。
与DNA相比,mRNA只需要获得细胞质的核糖体翻译机制而不用进入细胞核,因此没有整合到人体基因组的风险。与蛋白质和病毒系统相比,mRNA的制造是在细胞外快速制备的,并且蛋白质产物具有天然的糖基化和构象性质。当与脂质纳米颗粒(LNP)递送系统结合时,mRNA LNP的纳米结构特性也与病毒系统和循环的内源性含脂质乳糜微粒的大小、脂质包膜和内部基因组物质等方面具有相似性,并且有助于其作为疫苗和其他zhi疗药物的递送载体材料。
mRNA的难点在于其先天的免疫原性,对酶降解的敏感性以及细胞对裸露的mRNA摄取几乎可以忽略不计。mRNA的先天免疫原性是由于toll样受体(TLRs)、解旋酶受体(包括视黄酸诱导基因I (RIG-I)样受体(RLRs)等)对单链和双链RNA的识别,然后这些受体通过NF-κB和干扰素(IFN)调节因子IRF3和IRF7发出信号并转位到细胞核,与I型IFN基因启动子结合,诱导I型IFN(IFN-α和IFN-β)的表达,并伴有促炎细胞因子产生,如**坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-12(IL-12)。分泌的干扰素作为一种病毒防御机制,通过其受体和同一细胞及相邻细胞中的JAK/STAT途径发出信号,**300多个受干扰素刺激的基因,包括蛋白激酶PKR。
虽然这种**可能有利于对mRNA疫苗产生免疫反应,但直接作用是通过eIF2a的PKR磷酸化来下调翻译,这样损害了eIF2的活性,抑制了mRNA翻译,从而抑制了免疫原的蛋白质合成。消除这种先天免疫反应的主要方法是将天然存在的核苷如1-甲基二脲苷和核糖体RNA(通常不在mRNA中)中存在的其他核苷替换到mRNA序列中,这使得它不能被先天免疫传感器检测到。这种核苷修饰的免疫应答mRNA是mRNA技术的基础,该技术近在BioNTech/辉瑞和Moderna疫苗试验中显示了超过94%的有效性,这些技术是建立在对其他病原体试验的基础上,下文将详细描述。
由于TLR7和TLR8主要识别富含GU的单链RNA序列,CureVac采用了第二种方法包括密码子优化和尽量不使用鸟苷酸。mRNAzhi疗的第二个难点是其对核酸酶的敏感性,例如在它血清中的半衰期< 5分钟。尽管siRNA的化学修饰在提高稳定性和降低免疫原性方面非常成功,但迄今为止,由于翻译机制对化学修饰的敏感性,使得它们在mRNA修饰并不成功。mRNA的第三个难点是大多数细胞类型(除不成熟的树突细胞外)缺乏对裸露的mRNA的细胞摄取吸收。
后两个难点可以通过将核苷修饰或mRNA导入适宜递送系统来解决,这样既保护mRNA免受核酸酶的攻击,又促进细胞摄取。比如,当在动物模型中给药时,与裸露的mRNA相比,加入纳米颗粒脂质体可保护mRNA免受核酸酶的攻击,并增强细胞摄取和表达高达1000倍。
质粒DNA主链通过体外转录(IVT)产生zhi疗性mRNA,其带有5’端的帽子结构、5’端的非翻译区(UTR)、编码目的蛋白开放阅读框、3’端UTR和polyA尾。天然真核生物的5’端帽子(cap0)是一种倒置的7-甲基鸟苷(m7G),通过5’-5’三磷酸盐与mRNA的**个核苷酸相连。
Cap0保护内源性mRNA免受核酸酶攻击,参与核输出,与翻译起始因子4结合,启动蛋白质翻译。另外两个5’端帽子结构被证实(帽子1和帽子2)在第二个或第三个核糖核苷酸上含有额外的甲基,其免疫原性低于cap0(因此更佳)。目前常用的加帽方法包括共转录加帽,产生具有高翻译和低免疫原性的帽子1。5’端UTR参与翻译起始,包含一个Kozak序列以及一个非帽依赖翻译的核糖体进入位点。开放阅读框之后是3’端UTR,它影响mRNA的稳定性和蛋白质表达的持久性。polyA尾在大约100个残基上编码,有助于启动翻译和延缓降解。体外转录(IVT)生产的mRNA需要经过纯化,以去除具有免疫原性的DNA和双链RNA污染物。
上述的mRNA可以是核苷修饰的,也可以是未经核苷修饰的序列,但不能进行自我复制。能够复制的自扩增mRNA (samRNA)也正在进行临床试验测试,其长度约为10 kb,由于它们有四个额外编码的非结构基因,包括一个RNA依赖的RNA聚合酶,导致了细胞内的自复制,但由于缺乏结构基因,不会产生感ran性粒子。
samRNA不能被核苷修饰,因为这些修饰会干扰自身扩增。在目前的临床试验中,由于samRNA的扩增过程,其通常使用较低的剂量(1-10 μg),而非扩增的mRNA则需使用30-100 μg。表1总结了目前所有上述类别在进行人体临床测试的mRNA疫苗。这些临床试验中的所有mRNA递送系统都是纳米颗粒脂质体。
BioNTech/辉瑞LNP和Moderna LNP已经公开其确切方,而其他一些公司尚未公开。其他产品很可能与Alnylam公司的 OnpattroTM产品相似(下文将进一步描述),就像已经公开的产品,可能都包含用的可电离脂质。虽然所用的特定可电离脂质可能未知,但其常用种类可以从期刊和**出版物中了解,如表1所示。
表1:目前在进行人体临床测试采用纳米颗粒脂质包裹的mRNA疫苗总结如下。临床试验中的所有mRNA疫苗都使用纳米颗粒脂质体进行递送。其类别和组成尚未公开,因此基于现有文献和**,它们可能的类别如下所示。

在之前,mRNA疫苗用于传染病的临床前和临床研究,包括流感、寨卡病毒、艾zi病毒、埃博拉病毒、狂犬病、基孔肯雅病毒、疟疾、生殖器疱疹、弓形虫等。这些研究被总结在近的一些综述中。
COVID-19
SARS-CoV-2
LNP:脂质纳米颗粒
CNE:阳离子纳米乳剂
NLC纳米结构脂质载体
PBAE:聚β氨基酯
PACE:聚(胺-共-酯)
Epo
hPBAE:超支化聚β-氨基酯
PEI:聚乙烯亚胺
pABOL:二硫化物连接的聚酰胺基胺
SPLP:质粒-脂质颗粒
SNALP:核酸脂质颗粒
IFN:干扰素
HAI:血凝抑制试验
CVnCoV:CureVac mRNA LNP
mAbs:单克隆抗体
VHH:Vh结构域
M2e:基质蛋白2外域
Tfh:滤泡辅助T细胞
疫苗的早期递送系统
鱼精蛋白是一种富含精氨酸的阳离子蛋白的混合物,与mRNA形成络合物。与裸露的mRNA相比,该络合物提高了转染效率。之后因为鱼精蛋白络合mRNA部分抑制蛋白质表达,引入了游离mRNA和鱼精蛋白络合mRNA的混合物。动态光散射实验表明,游离的mRNA的大小接近50nm,而鱼精蛋白/mRNA络合物的大小在250-350nm。
CureVac公司对狂犬病疫苗候选物CV7201就采用了这种方法,CV7201是一种冻干的、温度稳定的裸露的mRNA,由编码狂犬病病毒糖蛋白(RABV-G)的游离和鱼精蛋白络合mRNA组成。在Balb/c小鼠中,两次给予10 μg及以上的诱导的中和效价大于世界卫生组织的保护阈值,并且两次给予80 μg的剂量对大脑有保护作用。在一项通过皮下和肌内途径的注射80–640 μg剂量的1期人体试验中,*一个小组使用特定的注射装置接受了三次80–400 μg剂量,达到了世卫组织中和效价阈值。
其中101名参与者中有一名在高剂量下产生了严重的不良反应(贝尔麻痹),同时有5%的参与者也产生严重不良反应。不良反应的总体发生率很高,其中有97%在注射部位产生不良反应,有78%产生全身不良反应。由于鱼精蛋白络合mRNA的给药效果并不理想,CureVac公司采用了来自Acuitas的纳米颗粒脂质体递送系统,并证明在Balb/c小鼠中以0.5 μg的低剂量 (与鱼精蛋白络合mRNA的10 μg相比)和非人的灵长类动物中以10 μg的剂量给药极大提高了中和效价。T细胞反应的**以及引流淋巴结和注射部位中的白细胞介素-6(IL-6)和**坏死因子(TNF)表明了LNP在介导阳性免疫反应中的作用。目前已经启动了一项临床试验(NCT03713086),预计2021年将报道中期结果。
通过将阳离子脂质DOTAP与含有角鲨烯、山梨醇三油酸酯和聚山梨酯80的商业佐剂(MF59)在pH 6.5的柠檬酸盐缓冲液中混合,开发了用于mRNA递送的阳离子纳米乳剂(CNE)。将编码呼吸道合胞病毒糖蛋白(RSV-f)的自扩增mRNA和来自DOTAP的NP胺联合应用,后者与mRNA中磷酸盐的比例为7,生成了大小为129 nm的纳米颗粒。
采用这种方法的一个优点是能够分别存储CNE和mRNA,并且*在使用时将它们结合起来。在Balb/c小鼠中两次给药15 μg的中和效价高于亚单位佐剂疫苗的效价。在非人类灵长类动物中两次给药75 μg就可以达到可检测到的中和效价和T细胞反应。基于这一概念,一个**的团队创造了纳米结构脂质载体(NLC),它是CNE和脂质纳米颗粒的混合物,由液态油相(如角鲨烯)和饱和甘油三酯的固相脂质组成。NLCs含有编码sika梅花鹿免疫原的自扩增mRNA,其大小为40 nm,NP比为15,并且在单次注射低至0.1 μg或0.01 μg的剂量后能够在C57BL/6小鼠中产生保护性中和效价。
用于mRNA递送的聚合物
几十年来,阳离子聚合物已广用于核酸递送,例如包括聚赖氨酸、聚乙烯亚胺(PEI)、DEAE-葡聚糖、聚β氨基酯(PBAE)和壳聚糖。*简单方式即把过量阳离子聚合物与核酸混合,形成静电结合的阳离子多聚体。
尽管已经开发了许多聚合物,但它们不如用于核酸递送的脂质纳米粒先进,并且能将它们成功应用于的动物研究的疫苗有限。PBAE与PEG脂质混合,形成mRNA/PBAE/PEG纳米颗粒脂质体,能够在小鼠静脉注射后将mRNA递送至肺部。在静脉注射基因递送**后使用*******作为考察报告,一种可生物降解的聚合物,聚胺共酯(PACE)三元共聚物在mRNA递送中已经被验证。通过控制分子量和端基化学,PACE家族的一个10 kDa的结构实现了与TransIT相同的体外转染效率,TransIT是一种有效但有毒的、胶体不稳定的且大体积商业产品。*******在静脉注射20 μg时的体内表达效果是TransIT的5倍。
合成了超支化聚β-氨基酯(hPBAE)用于通过吸入将mRNA递送至肺。hPBAE mRNA复合物的大小为137 nm,在小鼠中雾化时能够转染25%的肺内皮细胞,吸入没有明显的毒性,表达水平是分支化PEI的10倍。合成了分子量在8 kDa至167 kDa之间的二硫化物连接的聚酰胺基胺(pABOL),它能够形成大小接近100 nm的多分散纳米复合物。
这些使用自扩增mRNA复合物的体内荧光霉素的表达结果与肌肉注射PEI相似。当对小鼠以增强免疫策略进行血凝素(HA)流感免疫原给药时,低分子量8 kDa的pABOL中和效价高,超过PEI。8 kDa的pABOL能释放1μg HA的自扩增mRNA,也能部分抵御致命的流感,防止死亡,但不能防止体重**下降。伦敦帝国理工学院的研究组认为,这种pABOL系统可以为SARS-CoV-2提供一种自扩增的mRNA免疫原,但使用pABOL给药SARS-CoV-2免疫原的效果比使用Acuitas优化的纳米颗粒脂质体给药的效果低1000倍。
总的来说,1μg pABOL中自扩增RNA产生的结合抗体和中和效价与0.001μg优化的脂质纳米颗粒相同(Dr. Anna Blakney)。许多其他聚合物系统能够在体外或体内递送mRNA,但仍需对疫苗进行测试。
研究进展
当前中SARS-CoV-2纳米颗粒脂质体的研究进展
*早的mRNA转染试剂是季铵化阳离子DOTAP结合可电离和促细胞融合的DOPE,从DNA转染得到,用于多种细胞类型中的mRNA转染。虽然在体外有效,但**性的阳离子季铵基团使这些大体积的脂质体迅速从体循环和靶向**肺中被**,并表现出毒性。
目前的LNP的前体是稳定的质粒-脂质颗粒(SPLP),它是通过结合促细胞融合的可电离的DOPE和季铵化的阳离子脂质DODAC而形成的,通过静电作用包裹质粒DNA,然后再用亲水的PEG包被脂质体,使其在水溶液中稳定,并在体内给药时限制蛋白质和细胞的相互作用。
递送机制*关键的一步是:细胞内吞后,DOPE在内涵体内被质子化,并且由于DOPE的锥形结构,可以与内涵体磷脂形成一个内涵体溶解离子对,以促进内涵体释放。SPLP后来进一步发展为含有siRNA的稳定化核酸脂质颗粒(SNALP),包括四种脂质:可离子化而非季铵化的阳离子脂质、形成季铵化两性离子的饱和双层脂质、DSPC、胆固醇和PEG-脂质。除了与核酸静电结合之外,SNALPs中的可电离脂质起到融合脂质的作用,并在内涵体中质子化,与内涵体磷脂形成膜不稳定离子对。目前已知DSPC有助于在PEG表面下形成稳定的双分子层。胆固醇起着多种作用,包括填充颗粒间隙、限制LNP-蛋白质相互作用以及可能促进膜融合。可电离的脂质的**作用是在生理酸碱度下保持中性,从而消除循环中的阳离子电荷,但在pH为6.5时在内涵体中被质子化,促进内涵体逃逸。
2018年获得临床批准的**siRNA产品的开发主要集中在优化可电离脂质,其次是PEG-脂质和LNP中四种脂质的比例,以及LNP组装和制备过程。根据分子形状假说,发现C18尾中不饱和键的**数目是提供一个通过醚类与二甲胺头部相连的二油酸尾部。
然而,将单一的连接体引入二油酸尾部,从二甲胺头部到连接体的碳数经过优化,导致LNP可电离脂质的pKa值接近可电离脂质DLin-MC3-DMA的6.4。优化的佳一步是将MC3/DSPC/胆固醇/PEG-脂质的这些脂质的摩尔比调整为50/10/38.5/1.5。
总体来说,从DLin-DMA到DLin-MC3-DMA的这一优化过程需要在数千种**中筛选300多种可电离脂质,并导致效果增加200倍以及有效剂量相应减少,以实现对> 80%的靶基因和**窗的长久抑制,OnpattroTM在2018年获得临床批准。为siRNA开发的这种MC3制剂是下文所述的LNP后续开发的基础(图1)。这些LNP在被批准用于SARS-CoV-2 mRNA疫苗后,正处于紧急使用。

图1:mRNA纳米颗粒脂质体结构。使用冷冻电子显微镜、小角中子散射和小角x光散射表明,mRNA脂质纳米颗粒包括低拷贝数的mRNA(1–10),并且mRNA在LNP中心与可电离脂质结合。PEG脂质与DSPC一起形成LNP的双层表面。胆固醇和可电离的脂质以带电和不带电的形式分布在整个LNP。可在*近的综述中获得其他递送系统的结构示意图。
为了递送核苷修饰的mRNA编码的免疫原,Moderna使用上述Onpattro制剂中的MC3进行了几项临床前和临床研究。通过在这些研究中将一类新的可电离脂质与MC3进行了比较,证实了MC3是可电离脂质。这一新种类包括脂质H,它是Moderna公司的SARS-CoV-2产品mRNA-1273(表2)中可电离的脂质SM-102。
使用核苷修饰的mRNA编码寨卡病毒免疫原,MC3 LNP能够保护缺乏ⅰ型和ⅱ型干扰素(IFN)信号的免疫低下小鼠,在免疫增强策略中使用一次10 μg剂量或两次2 μg剂量将抑制小鼠的死亡。在免疫功能正常的小鼠中,预先用抗ifnar1阻断抗体递送来建立一个致死模型,也得到了相似的结果。在一系列核苷修饰mRNA编码血凝素(HA)免疫原递送的流感研究中,皮下给药的MC3 LNP能够以低至0.4 μg的单剂量充分保护小鼠免受死亡,即使使用单剂量高达10 μg体重也还是减轻。
单剂量50 μg或100 μg在雪貂中产生高HAI(血凝抑制试验)效价,在非人的灵长类动物中两次给药200或400 μg也是如此。在被给药100 μg的一小部分(23名)受试者中,所有受试者的HAI效价> 40(世卫组织相关的保护指标),比研究开始时的基线高出4倍以上。在一个更大的I期试验中,使用相同的MC3 LNPs递送两种不同的核苷修饰的mRNA编码的HA免疫原,肌肉注射100μg H10N8免疫原导致所有23名受试者的HAI效价> 40。
尽管没有发生危及生命的不良反应,但这23名受试者中有3人产生了严重的3级不良反应。在三名受试者中有两名出现可以暂停试验的3级不良反应后,停止了预计的400 μg给药量。在较低剂量下,尽管几乎每个受试者都产生至少一次不良反应,但不良反应的频率和严重程度降低。这些研究是有前途的,也强调了相对狭窄的**窗,以不引起不良反应的剂量下获得保护性免疫。这让人想起MC3前体DLin-DMA狭窄的**窗,需要提高效价以降低剂量,但仍然能实现有效的基因敲除。
表2:纳米颗粒脂质体中使用的可电离脂质。纳米颗粒脂质体中使用的可电离脂质的一个关键特征是,通过TNS染料结合试验测量的LNP可电离脂质的pKa值应在6–7的范围内。大多数可电离基团的理论计算pKa值在8-9.5的范围内,如下所示的氮原子在水介质中,使用商业软件从理论上估计这些值。pKa值从理论值到TNS值下降了2-3个点,这是由于脂质相中质子溶剂化的能量高得多,导致在TNS分析过程中测量的脂质中的pH比水相的pH增加了2-3个点。


由于siRNA产品需要对慢性疾病重复给药,因此人们担心MC3中二醇烷基尾的缓慢降解会导致重复给药的累积和潜在毒性。MC3的生物可降解变体,脂质319(表2),是通过用一种在体内容易被酯酶降解的伯酯取代烷基链中的两个双键之一而产生的。脂质319在肝脏中的半衰期不到一小时,但它在肝脏中保持的基因沉默效率与MC3相似。
在体内的降解产物及其分泌和脂质319的无毒性质得到了证实。在SARS-CoV-2的临床前和临床研究中采用脂质319的这一研究为代,在BioNTech和CureVac产品中使用Acuitas LNP,尽管在伦敦帝国理工学院试验中自扩增RNA的Acuitas LNP给药被用于*近的专利申请中,以来自Acuitas的脂质A9代(参考表2)。*近,BioNTech批准的BNT162b2中的Acuitas可电离脂质是ALC-0315(表2)。这些LNP的一个重要特点是,它们是通过在静脉注射后筛选肝脏中的mRNA表达而开发的,可能还没有完全优化用于肌内注射mRNA的疫苗。
Moderna*近开发了一类新的可电离脂质来替代MC3,主要是由于上MC3缓慢降解,通过使其具有比二醇MC3烷基尾更大的分支来提高其效价。这种新型脂质有一个乙醇胺可电离的头部,连接到一个含有一级可降解酯的饱和尾部(如Maier 2013)和第二个饱和尾部,第二个饱和尾部在七个碳后使用一个不太可降解的二级酯分支成两个饱和C8尾部,如脂质5 (表2),其针对静脉注射到肝脏进行了优化,还发现一个类似的脂质H或SM-102,*适合进行肌肉注射疫苗。
Acuitas研发脂质的的一个特征是增加分支,脂质A9总共有五条支链 (表2),而Moderna LNP中SM-102有三条分支。增加的分支产生了一种具有更类似圆锥形结构的可电离脂质,因此,当阳离子脂质与内涵体中的阴离子磷脂配对时,将出现更大的膜破坏能力,符合几十年前的分子形状假说。
当静脉注射时,24小时内肝脏中未检测到脂质5,而MC3在肝脏中的初始剂量为71%,这验证了脂质5的降解性。静脉注射后,脂质5在小鼠体内的荧光素酶表达比MC3强3倍,在非人的灵长类动物体内的hEPO表达比MC3强5倍。效价的这些增加与内涵体释放的增加一致,并且推测可能是由内涵体释放的增加引起的,对于脂质5,细胞中多达15%的mRNA从内涵体中释放,而对于MC3,这一比例为2.5%,后者与之前使用siRNA测量的MC3相似。
然而,在这些内涵体释放实验中,MC3的细胞摄取率比脂质5的高四倍,因此这两种LNP在细胞质中释放的mRNA的**量是相似的。在肌肉注射疫苗时进行了同样的可电离脂质库研究,同样发现其可降解,并由于一级酯而迅速消除,并且与MC3相比,在蛋白质表达或免疫原性方面,小鼠中流感核苷修饰的mRNA编码免疫原的效果增加了3-6倍,尽管在非人的灵长类动物中的免疫原性与5 μg增强免疫剂量的MC3相同。
脂质H或SM-102(表2)被确定为**候选物,并且在结构上*与脂质5不同。脂质5通过伯酯的两个碳置换,是静脉给药的**药物。脂质5 LNP的pKa值为6.56,而脂质H LNP的值为6.68,这表明pKa值的轻微增加可能有利于肌肉注射和静脉注射给药,尽管这种差异在检测的可变性范围内。对大鼠肌肉注射部位的组织学检查表明,与MC3相比,脂质H LNPs吸引的富含中性粒细胞和巨噬细胞的炎症浸润较少,这可能会降低人体试验中注射部位的反应原性。
脂质纳米颗粒在当前SARS-CoV-2临床试验中的应用
1 BioNTech/辉瑞
BioNTech在SARS-COV-2试验的递送系统脂质成分主要是Acuitas的ALC-0315(表2)、DSPC、胆固醇和PEG-脂质。CureVac和伦敦帝国理工学院可能也使用ALC-0315或A9(表2)。BioNTech开始用四种mRNA编码的免疫原开发SARS-CoV-2疫苗,其中两种是核苷修饰的,一种是未修饰的,一种是自扩增的。
其中有关两种核苷修饰的mRNA:BNT162b1是一种较短的、约1 kb的序列,其编码刺突蛋白的受体结合结构域,由折叠三聚结构域修饰,通过多价显示增加其免疫原性;
另一种BNT162b2是较长的、约4.3 kb的薛烈,其编码二脯氨酸稳定的全长的膜结合刺突蛋白。BNT162b2最近获得了欧盟和美国的紧急批准。在一项临床前研究中,单次给药0.2、1和5μg的BNT162b2后,可检测到小鼠体内的结合抗体和中和效价,从**剂量到**剂量增加一个数量级,并在Th2细胞因子水平非常低的CD4+和CD8+脾细胞中引起强烈的抗原特异性Th1 IFNγ和IL-2反应。引流淋巴结也含有大量生发中心B细胞和CD4+和CD8+ T滤泡辅助细胞(Tfh)的数量也升高,这些细胞以前被认为是由mRNA LNP疫苗中LNP单独诱导。
在非人的灵长类动物中,30 μg或100 μg的免疫增强剂量引起的结合抗体和中和效价是人类恢复期组的10倍以上,并产生强烈的Th1偏向性T细胞反应,这对预防疫苗相关的增强型呼吸道疾病很重要。在6只的猕猴中,两次给药100 μg后在支气管肺泡灌洗液和鼻拭子中检测不到病毒效价。对较小的mRNA编码免疫原BNT162b1的1期临床试验中计划在第1天和第21天给药10、30和100 μg。中等剂量30 μg诱导的抗体结合和中和效价分别比人类恢复期组高30倍和3倍。由于第一次给药后出现严重的注射部位疼痛,因此未给予100 μg剂量的增强剂量。给药30 μg的增强剂量后100%的受试者产生轻度或中度的注射部位疼痛。第二次接种30 μg剂量后,几乎所有受试者都经产生了轻度或中度的全身不良反应,如发热、寒战或疲劳。该试验还证明了来自外周血单核细胞有强Th1偏向性T细胞反应。
一项2期临床试验比较了年轻(18-55岁)和年长(65-85岁)受试者组接种 BNT162b1和BNT162b2后的一些指标。老年组的结合和中和抗体效价略低,但仍高于恢复期组的受试者。与年轻组相比,老年组的不良反应严重程度也降低了。BNT162b2与BNT162b1相比,全身不良反应(发热、寒战、疲劳)的发生率**降低了约两倍。正是BNT162b2耐受性的增加推动了其3期临床试验,最近该试验宣布有效率达到94%,因为安慰剂组出现了162例COVID-19感ran,而接受两次30 μg剂量BNT162b2的接种组*发现8例感ran。
2 Moderna
在Moderna的研究中,核苷修饰的mRNA编码的免疫原是一种跨膜锚定的二脯氨酸稳定的预融合刺突,具有天然的呋喃裂解位点,并以LNP递送,该LNP参照MC3 LNP原型,但用脂质H (SM-102)替代MC3。mRNA LNP (mRNA-1273)接种剂量为1 μg而非0.1 μg,小鼠接种第1天和第21天,能诱导产生中和抗体。T细胞反应似乎是一种Th1/Th2平衡的反应,在小鼠的病毒模型中,两次给药1 μg(非0.1 μg)后,小鼠肺部和鼻甲的病毒效价降低到基线。以猕猴为实验对象,两次给药剂量为100 μg,给药后能产生高结合和中和效价以及在外周血中产生Th1偏向反应,同时也有强Tfh反应。两次给药10 μg剂量后效价和T细胞反应**降低。
同样,100 μg剂量能够将支气管肺泡灌洗液和鼻拭子中的病毒效价降低到基线水平,而10 μg剂量*在肺部有效。在一项1期临床研究中,每组15名患者,给药频率为间隔4周2次,给药剂量为25、100或250 μg,100 μg剂量的结合和中和效价比恢复期高约10倍,相当于25 μg的恢复期。所有受试者在100 μg和250 μg剂量下均产生了不良反应,250 μg组的14名受试者中有3名发生了严重的不良反应,并被停药。在随后对老年患者(56-71岁和71岁以上)进行的1期临床研究中,发现25 μg和100 μg剂量产生的结合抗体效价高于恢复期血浆中的,而中和效价与100 μg相当,但低于恢复期的25 μg。
即使是在老年组也有约80%的患者在第二次接种疫苗后仍出现不良反应。外周血分析显示CD4 T细胞反应是Th1偏向型的。与25 μg剂量相比,100 μg剂量的中和效价更高,因此进一步进行了3期临床试验,中期结果显示,安慰剂组出现了90例COVID-19感ran,而接种疫苗组只有5例感ran,防护有效率达到94.5%。一**委员会对Moderna的3期临床试验的中期分析结果表明,出现严重不良反应包括:9.7%的接种者出现疲劳、8.9%的接种者出现肌肉疼痛、5.2%的接种者出现关节tong、4.5%的接种者出现**,而在辉瑞/BioNTech的3期临床试验中,出现疲劳的频率较低,只有3.8%,**为2%。
3 CureVac
CureVac mRNA LNP (CVnCoV)采用的是一种非化学修饰的、序列工程mRNA,它编码一种二脯氨酸稳定的全长的S蛋白,采用Acuitas LNP递送技术,可能使用可电离脂质ALC-0315。小鼠实验中剂量为2 μg时,对两次给药之间的周数(从1到4不等)进行了研究,发现较长的时间间隔在Balb/c小鼠中产生更高的效价和T细胞反应以及平衡的Th1/Th2反应。产生中和抗体需要第二次给药,两次给药0.25 μg不足以产生中和抗体。在叙利亚金黄地鼠实验中,两次给药10 μg (非2 μg)能够将肺(非鼻甲)中的病毒效价降低到基线。在剂量为2-12 μg的1期临床试验中,*在**剂量12 μg时发现中和效价达到恢复期血清水平,这使得较高剂量(16和20 μg)被纳入正在进行的2期临床试验。所有给药剂量为12 μg的患者在每次给药后都产生了全身不良反应,大多数为中度和重度,而> 80%的患者在局部注射部位产生了轻度和中度疼痛。
4 TranslateBio
Translate Bio使用的是一种非修饰的mRNA,其编码双突变的二脯氨酸稳定的刺突蛋白,采用LNP技术平台,使用可电离脂质C12-200,C12-200很可能是近期的基于ICE-或半胱氨酸的可电离脂质家族合成的候选物。在Balb/c小鼠实验中,发现在0.2-10 μg范围内两次给药使结合和中和效价远高于恢复期水平。在非人的灵长类动物实验中,15、45和135 μg剂量均产生超过人类恢复期的效价,并且其免疫反应也是Th1偏向型的。
5 Arcturus
Arcturus使用的是一种自扩增的、全长的、未修饰的mRNA,其编码融合前SARS-CoV-2全长的刺突蛋白,该LNP中使用带有硫酯的可电离脂质,通过两个额外的酯基将含胺的头部和脂质尾部相连接。这个脂质家族中两种可能的可电离脂质是脂质10a(在[111]的表4中)或脂质2,2 (8,8) 4CCH3(在[57]的第33页上)(表2)。
后者有三个分支,类似于Moderna脂质H,但有一个可降解的硫酯连接到头部。自扩增mRNA的一个特征是荧光素酶基因的表达在肌肉注射给药一周后保持在相当恒定的水平,而常规mRNA的表达则迅速下降。在C57BL/6小鼠中,单独接种疫苗使体重减轻和临床评分增加。在具有高水平抗原特异性T细胞反应的Th1偏向反应中,只需要对小鼠以2 μg或10 μg(非0.2 μg)的剂量单次给药,就可以使中和效价达到100以上。在K18-hACE2小鼠致死模型中,单次给药2 μg或10 μg也可以100%保护小鼠,并且小鼠体重没有减轻,且肺和脑的病毒效价降低到基线。Arcturus已经完成了接种剂量为1-10 μg的1期临床试验,并选择使用7.5 μg作为接种剂量进行3期临床试验。
6伦敦帝国理工学院
伦敦帝国理工学院使用了一种由Acuitas LNP技术递送的、自扩增的编码预融合的稳定的刺突蛋白的mRNA,该蛋白在由脂质A9的**中有所描述(表2)。在Balb/c小鼠中两次注射0.01 μg至10 μg的剂量后,产生了非常高的剂量依赖性抗体和中和效价。该反应是强Th1偏向型,与较低的0.1和0.01 μg剂量相比,10和1 μg的剂量产生了高三倍的抗原特异性脾细胞反应。该疫苗即将开始1期临床试验。
7 朱拉隆功大学,宾夕法尼亚大学
朱拉隆功大学与宾夕法尼亚大学合作,使用Genevant LNP技术开发一种天然刺突免疫原核苷修饰的mRNA LNP,采用的脂质可能是CL1。他们的目标是于2021年第一季度开始第一阶段临床试验,并于2021年第四季度开始向泰国和七个周边中低收入国家供应疫苗。
8 Providence Therapeutics
Providence Therapeutics获得了加拿大卫生部的授权通知,可以对PTX-COVID-19B mRNA LNP疫苗进行人体临床试验。对编码受体结合域(具有或不具有呋喃裂解位点突变的全长刺突蛋白)的三种候选mRNA进行临床前研究,按照免疫增强方法以C57BL6小鼠为实验对象以20 μg的剂量给药。
该疫苗使用来自Genevant的未公开脂质(可能与表2中的CL1相似)的临床前数据,显示出全长的和呋喃突变的有效载荷具有强大的中和效价。第一阶段临床试验计划于2021年第一季度开始,同时疫苗的生产和销售计划于同年获得监管机构的批准。
9 储存和供应
实验室制造的大多数RNA LNP可以在4℃下保存几天,但随后出现颗粒尺寸增加和生物活性逐渐丧失(如荧光素酶表达)的特点。在以前的siRNA LNP方中,通常由于LNP聚集导致尺寸随着时间增大。为了mRNA LNP疫苗能稳定的储存和供应,需要采用冷冻形式。Moderna的COVID-19疫苗需要在-25℃至-15℃之间储存,在2℃至8℃之间可稳定储存30天,在8℃至25℃可稳定储存12小时。
辉瑞/BioNTech的COVID-19疫苗需要在-80℃至-60℃之间储存,解冻之后在2℃至8℃之间储存最多5天,然后在注射前用盐水稀释。在储存和运输过程中,辉瑞疫苗所需的极低温度比Moderna疫苗所需的常规冷冻温度更难达到。这些温度差异背后的原因并不明显,因为两种疫苗都含有类似的高浓度蔗糖作为冷冻保护剂。Moderna的mRNA LNPs被冷冻在Tris和醋酸盐两种缓冲液中,而辉瑞/BioNTech疫苗*使用磷酸盐缓冲液。众所周知,磷酸盐缓冲液不适合冷冻,因为它们容易沉淀而且结晶会引起pH突变。冻干工艺对mRNA LNPs来说是一个技术难点。然而,Arcturus已经声明,他们的COVID-19 mRNA疫苗在冻干形式中是稳定的,尽管这种冻干制剂的温度稳定性尚未公开,但这可能会**简化供应。
脂质纳米颗粒
许多脂质样实体,称为脂质类化合物类脂,最初是为siRNA递送而开发的,随后用于mRNA递送。C12-200就是一个例子(表2),由于其通过静脉给药在肝细胞基因沉默中的高效性,而在类脂家族中脱颖而出。为了实现高效的肝脏靶向基因沉默,C12-200与MC3 Onpattro原型相同的脂质相结合,即50%可电离脂质、10% DSPC、38.5%胆固醇和1.5% PEG-脂质。
后来的一项研究发现,通过将可电离脂质的百分比降低到35%,同时将可电离脂质与核酸的重量比从5增加到10,并用促细胞融合的不饱和DOPE取代DSPC,可以将C12-200对同一肝脏靶点的mRNA递送效率提高7倍。
有趣的是,这种优化的方将mRNA表达提高了7倍,但没有改变siRNA的沉默效率。在这种方中,C12-200也被研究用于小鼠和非人灵长类动物的mRNA介导的蛋白质替代疗法,但是当皮下注射时,通过组织学观察,它会产生强烈的炎症反应。C12-200是一种小分子树状聚合物,具有五个烷基链和五个氮原子,根据ACDLabs Percepta等商用软件进行电离分析,发现其中三个似乎是可质子化的(表2)。另一种树枝状大分子脂质,5A2-SC8,在观察过程中发现对肝脏具有高siRNA传递效率,并且还具有五个氮原子和五个短烷基链(表2)。
类脂5A2-SC8对于mRNA递送的效率很低,除非通过将可电离的脂质摩尔分数降低到24%,使用DOPE代替DSPC,并增加其他脂质比例来改变其方参数,但是同时5A2-SC8与mRNA的重量比将增加到20。
这些方的改变似乎是这些树枝状大分子型类脂成为有效的mRNA递送载体所必需的,这可能是因为它们具有多质子的头部和树枝状大分子结构。另一种非常高分子量的修饰树枝状大分子被用于递送编码流感、埃博拉和弓形虫免疫原的自扩增mRNA,并且在小鼠实验中,在单次给药40 μg的高剂量或免疫增强方法注射4 μg后(这对复制RNA也是高剂量),发现可以避免三种病原体的感ran。最近对类脂进行研究发现,与其他类脂相比,这种小的三氮树枝状大分子的四个烷基链末端增加一个碳支链,肝脏表达能力提高了10倍以上。
这种效价的增加与LNP的pKa值没有相关性,但与pH为 5时TNS染料的**荧光有相关性,这表明内涵体质子化的幅度与mRNA表达相关,推测可能是促进内涵体逃逸。根据分子形状假说,增加的碳支链也可以产生一个更锥形的结构,从而产生更多的膜破裂。
编码抗体基因的mRNA LNP的递送
目前市场上有70多种单克隆抗体(mAbs),全球销售额为1250亿美元。使用mRNA编码的抗体具有以下优势,包括有益于天然翻译后修饰的内源性蛋白质合成,以及是一种不需要细胞培养和对蛋白质产品大量纯化和表征的简化生产方法。通过将编码VRC01(一种针对HIV-1的中和抗体)轻链和重链的纯化核苷修饰的mRNA包封到Acuitas LNPs中,显示出递送mRNA编码的mAbs可能用于被动免疫。
以 Balb/c小鼠为实验对象,静脉注射30 μg mRNA LNP(靶向肝细胞),表达mAbs超过一周,血清水平达到150 μg/ml,高于直接注射600 μg mAbs,每周注射能够保持血清水平在40 μg/ml以上。CD34-NSG人源化小鼠注射30 μg和15 μg的mRNA LNP可以抵御24小时后的HIV-1攻击,入侵2周后的血清病毒RNA复制分析也证明这一观点。
CureVac的一项研究证实了**性非修饰mRNA编码抗体的可行性,该研究也使用了Acuitas LNPs,其中选择了对多种狂犬病毒株具有**中和能力的IgG mAbs,以及针对肉毒杆菌**的纯重链Vh结构域(VHH)中和剂。还生产了一种靶向CD20的、mRNA编码的利妥昔单抗,其中CD20是非霍奇金淋巴瘤**的**。
动物实验通过静脉注射使用的是靶向肝细胞的Acuitas LNP。小鼠单次给药40 μg产生的血清抗体水平刚刚超过10 μg/ml,1个月后逐渐下降到1 μg/ml。相同剂量下,VHH单结构域中和剂产生的抗体水平高10倍,但由于缺乏Fc区,半衰期*有几天。当在狂犬病病毒的致命攻击之前1天或之后2小时,对小鼠单次静脉注射40 μg也能够完全保护小鼠。
同样,在致命的肉毒杆菌**攻击后6小时单次给药40 μg也完全保护了动物。第三个攻击模型是将Raji-luc2 B细胞淋巴瘤细胞静脉移植并且生长4天,然后在18天内,在Acuitas LNP中5次给药10或50 μg mRNA编码的利妥昔单抗,结果是保护了所有动物,并且50 μg剂量能够完全消除**生长。
将T细胞募集到**细胞的双特异性抗体也被编码在修饰的mRNA结构中,并使用商业转染试剂TransIT在体内递送,该试剂在肝脏递送方面不如目前的LNP有效。
该mRNA结构可维持循环和生物活性的双特异性抗体超过6天,而相同5 μg剂量的蛋白质-双特异性抗体在**后减少至接近基线。第二项研究也是使用VHH形式的双特异性抗体进行的,其中一个结合保守的甲型流感基质蛋白2外域(M2e)的VHH基因与另一个小鼠Fcγ受体IV (FcγRIV) 特异性结合的VHH基因相连,以便将表达FcγRIV的先天免疫细胞募集到表达M2e的流感感ran细胞中。
这些核苷修饰过结构的mRNA使用DOTAP/胆固醇制备的LNPs递送,通过气管内滴注到小鼠肺中,4小时后,用致死剂量的流感病毒攻击,80%的小鼠免受致死剂量的影响,尽管它们产生明显的体重减轻,并且DOTAP/胆固醇mRNA纳米粒导致粒细胞暂时流入肺部,同时血清IL-6细胞因子水平也有所升高。
**,在基孔肯雅感ran幸存者的B细胞中发现的一种有效中和抗体被编码在一种核苷修饰的mRNA结构中,该结构由一个可能含有MC3或脂质5的LNP递送。静脉注射0.5 mg/kg(10 μg)编码mAb的mRNA,24小时预注射的小鼠获得了抗病毒攻击的保护作用,而注射蛋白mAb需要2 mg/kg的剂量。在感ran后4小时,对小鼠注射高剂量10 mg/kg (200 μg),使小鼠避免感ran。非人的灵长类动物研究中发现,3 mg/kg(9 mg)的高剂量产生的短暂毒性(包括脾脏增大和CCL2血清水平升高)最小,且注射后几个月仍可检测到抗体。基于这些结果,Moderna启动了一项1期临床试验,并公布了阳性结果,其中0.1和0.3 mg/kg的剂量耐受性良好,并且mAb的血清水平在1–14 μg/mL的范围内,预计单次给药后可对基孔肯雅病毒具有长达16周的免疫作用。
脂质纳米颗粒组装和结构
目前mRNA脂质纳米颗粒的生产方法是利用微流体或T型接头,把含有疏水性质的乙醇相和含有mRNA的水相在pH为4的缓冲液(如乙酸)中混合(图2)。现有的方法(如薄膜蒸发法和乙醇注入法),由于纳米粒子粒径不稳定、mRNA包封率较低、难以扩大规模而很少使用。微流体混合的优点是能够将乙醇中非常小体积的脂质与几十μL水溶液中的mRNA混合,从而可以筛选许多成分和方参数。另一方面,T型接头混合器是大批量商业生产mRNA LNPs的通用方法,例如目前临床试验中使用的方法。
最近的一份期刊表明,这两种方法都可以生产有类似大小和形态的LNP。两种溶液的快速混合是控制粒径< 100 nm的关键,从而避免了其他生产方法所需的尺寸减小的需要(挤出、超声处理)。如图2所示,由这些溶液组装和形成LNP的过程是由疏水力和静电力驱动的。四种脂质(可电离脂质、DSPC、胆固醇、PEG-脂质)最初可溶于乙醇,可电离脂质非质子化且呈电中性(图2A)。通常将一体积的含脂质的乙醇溶液与三体积的mRNA在pH=4的醋酸盐缓冲液中混合,这使得脂质接触缓冲液时,它们变得不溶于3∶1的水/乙醇溶剂,并且可电离的脂质质子化携带正电荷,然后与mRNA的带负电荷的磷酸骨架静电结合(图2B),形成包封mRNA的脂质颗粒,同时脂质在主要是水的悬浮液中变得难溶。
这一过程中的一个关键成分是PEG-脂质,因为PEG链是亲水性的,从而包覆颗粒,并决定其最终的热力学稳定尺寸大小。通过改变PEG的摩尔分数,可以控制LNP的大小,例如,LNP颗粒大小为100 nm时PEG-脂质的摩尔分数为0.5%,而43 nm时PEG-脂质的摩尔分数为3%。最近一个研究显示,当mRNA LNP悬浮液在水溶液缓冲液中稀释或透析以提高pH并去除乙醇时,LNP的结构和大小在混合后继续发生变化。水相和脂质相混合时初始pH值接近5.5,使可电离脂质质子化,其LNP的pKa接近6.5,可以与mRNA结合和包裹(图2B,C)。
之后通过稀释、透析或切向流过滤提高pH可以中和可电离脂质,直到pH为7.4时可电离脂质基本不带电(图2D)。当可电离脂质变为电中性时,它也变得更难溶解,导致形成更大的疏水类脂结构域,从而促进LNP的融合,使LNP的尺寸增大,LNP的中心形成无定形的电子致密相,主要包含与mRNA结合的可电离脂质。据估计,在这个过程中,多达36个囊泡可以融合形成最终的LNP(图2C,D)。使用FRET对证实了这一融合过程,并进一步看到了PEG-脂质在这一过程中的作用,因为混合后加入PEG-脂质与混合前加入PEG-脂质以相同的方式控制最终LNP的大小。这项研究和另一项使用中子散射方法的研究也表明,DSPC在LNP的**PEG层的下面形成了一个双层结构,其**主要是与mRNA结合的可电离脂质(图2D),同时认为胆固醇分布在整个LNP中。
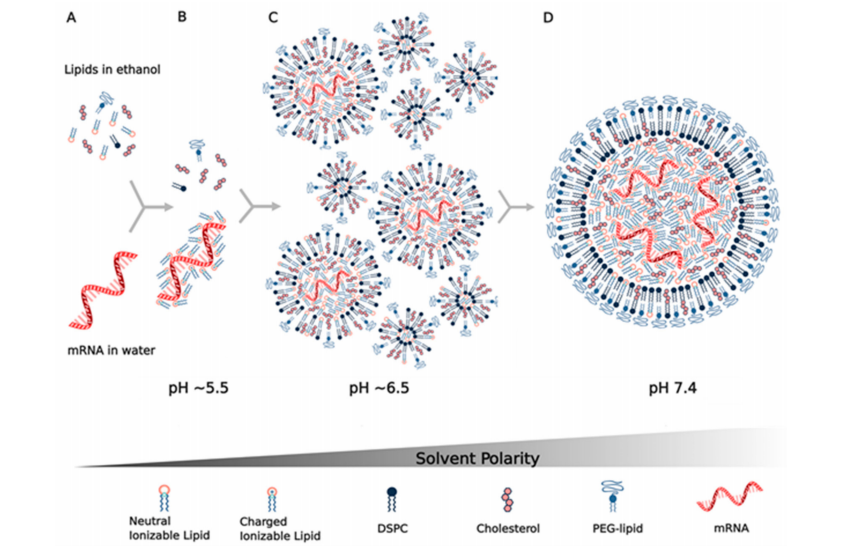
图2:mRNA脂质纳米颗粒的组装是通过(A)在微流体或T型接头混合器中将四种脂质(可电离脂质、DSPC、胆固醇、PEG-脂质)在乙醇中与mRNA在pH4左右的水溶液缓冲液中快速混合而实现的。
(B)当可电离脂质与水相接触时,在pH~5.5范围内质子化,该pH介于缓冲液的pKa和可电离脂质的pKa之间。
(C)可电离脂质与mRNA的阴离子磷酸骨架静电结合,同时它在水相中经历具有疏水性,驱动囊泡的形成和mRNA的包裹。
(D)在初始囊泡形成后,通过稀释、透析或过滤提高pH,中和可电离脂质,使其疏水性增强,从而驱动囊泡融合,导致可电离脂质与mRNA进一步包裹在脂质纳米粒的内部。通过给LNP提供亲水性的外表、确定其热力学稳定的尺寸大小,PEG-脂质的含量停止融合,在PEG-脂质层的下面形成DSPC的双层结构。
疫苗的mRNA递送系统性能的决定性因素
mRNA递送系统的性能决定因素是多因素且相互作用的,包括:(1)它们向靶细胞递送的能力,并将mRNA有效地释放至细胞质并进行翻译的效率;(2)佐剂,可以增强免疫反应;(3)将注射部位或全身分布的过度炎症和脱靶表达可能引起的不良反应或毒性降至低。
剂量
目前在SARS-CoV-2临床试验中追求的大剂量范围给药(从1 μg到100 μg),能够评价mRNA递送系统的效率(表1)。临床试验中的剂量主要分为较高剂量(30-100 μg)的核苷修饰RNA(Moderna,BioNTech),较低剂量(7.5-20 μg)的未修饰的RNA(CureVac,Translate Bio),甚至更低剂量(1-10 μg)的自扩增RNA(Arcturus,伦敦帝国理工学院)。
决定这些剂量的因素有两个:与恢复期血浆相比,中和抗体效价和T细胞反应水平,以及在每个剂量下发生不良反应的频率和严重程度。第一阶段临床试验中所有高剂量实验的中止就证明了SARS-CoV-2疫苗有一个相当狭窄的接受窗口,达到保护所需的剂量产生了难以接受的不良反应的频率和严重程度。在BioNTech第一阶段临床试验中测试的两种核苷修饰的RNA与恢复期血浆相比,具有较高的中和效价,而由于编码膜结合的全长刺突蛋白的较大结构RNA发生不良反应的频率和严重程度较低,因此进行了第三阶段临床研究。值得注意的是,剂量以质量表示,而摩尔剂量取决于结构的长度,而且,根据递送系统的效率和靶向特性,实际翻译的mRNA量只是两者中的一小部分。
在预防传染病的mRNA疫苗的动物研究中,当使用鱼精蛋白、树枝状大分子和早期阳离子脂质系统时,在小鼠中能够产生中和抗体或抵御病毒的初始剂量高达10-80 μg(表3)。当之后使用*近的LNPs递送的mRNA疫苗时,小鼠中和所需的剂量在给药两次时降低到接近1 μg,而对于未修饰的mRNA,所需剂量更低,接近0.25 μg。对于自我扩增的mRNA,剂量可以更低,只需要两次给药0.1 μg或一次给药2 μg。在较大的动物模型(仓鼠、雪貂和非人的灵长类动物)中,可用的研究较少,剂量范围很广,从5 μg到200 μg,没有明显的模式。
有趣的是,当使用体表面积将人的剂量转换为动物的剂量时,60 kg人的100 μg剂量相当于3 kg猕猴的15 μg剂量和20 g小鼠的0.4 μg剂量,这两个数据与表1和表3中的LNPs大致相同。显然,给药系统在确定有效剂量方面起着重要作用。人们强烈希望提高给药效率,以减少剂量和维持效价,因为这有望通过减少mRNA和给药载体的局部反应和脱靶效应来降低不良反应的频率和严重程度。减少剂量还将降低每个人接种疫苗所需的原材料数量和相关成本。特别是当前的COVID-19大流行使人们关注到mRNA LNP疫苗的一些重大供应链和生产能力的限制,这一状况可以通过更有效的递送系统加以改善。
表3:体内预防性接种的mRNA剂量。不同的mRNA传递系统和不同的物种显示了诱导中和抗体效价或抵御病毒攻击所需的mRNA的剂量。与早期的递送系统相比,脂质纳米颗粒(LNPs)递送的mRNA的所需剂量减少了10倍。

效价和递送效率
已经有许多研究试图确定LNP和其他核酸递送系统的结构-功能的关系。决定其效价或传递效率的LNP*常用的参数是pKa。pKa是使LNP中50%的可电离脂质质子化时的pH。到目前为止,LNP的pKa通过一种叫TNS的染料来测定,TNS是带负电荷的,当与带正电荷的LNP结合时,产生荧光增效果好果。
用TNS培养的LNPs在pH范围较大的缓冲液内进行荧光测量,以推断染料与表面电荷的结合,估算pKa,发现达到了大荧光的一半。众所周知,基于MC3的Onpattro LNP在静脉注射后使肝细胞沉默的佳pKa为6.4。TNS的pKa在6.2-6.8范围内对任何一种LNP都有一个肝细胞沉默的佳值。解释这种依赖于pKa的原理是基于LNP的可电离脂质在pH为7.4时接近中性,而在它进入细胞后,内涵体的pH值随着内涵体途径的演变而开始下降,使可电离脂质质子化,而可电离脂质又将结合到内涵体的一个阴离子内源性磷脂上并且破坏其双层结构,从而将mRNA释放到细胞质中用于核糖体翻译表达蛋白。
内涵体逃逸需要可电离脂质的另一个特征,即锥形的形态,其中脂质尾部的横截面大于其头部。这使得可电离的脂质/内涵体磷脂离子对和双层结构不相容,并且更有可能形成倒六边形的结构,从而破坏内涵体的膜结构。这也被称为分子形状假说,它解释了为什么在饱和的C18烷基链上引入一个或两个双键会产生更多的锥形和更少的圆柱形的形态,即膜的破坏和内涵体逃逸。
这两个C18亚油酸的尾部,与二甲胺头部的适当的、调节好的pKa结合,是MC3可电离脂质所定义的特征。取代MC3用于mRNA传递的可电离脂质保留了pKa的要求,但通过在烷基尾部引入更多的支链来追求更大的内涵体裂解特性。例如,来自Moderna的脂质H和脂质5和Arcturus的脂质2,2(8,8)4C CH3一样,有三个烷基尾部,而Acuitas的ALC-0315有四个烷基尾部,A9有五个烷基尾部(表2)。这种增强的锥形形态解释了含有这些可电离脂质的LNPs是更有效的递送载体,具有更强的内涵体逃逸。
虽然LNP的pKa和分子形状假说对LNP的递送效率有很好的贡献,但其他因素也很重要,如LNP表面PEG-脂质的稳定性,以及四种脂质在乙醇溶液中的比例,这些因素*终决定了LNP的超微结构。如上所述,PEG-脂质通过提供亲水性外壳来控制LNP的大小,该外壳在组装过程中限制囊泡融合,从而使较高的PEG-脂质浓度产生较小的LNP。
如一项研究表明,将PEG-脂质的摩尔分数从0.25%改变到5%,可以将LNP的大小从117 nm减少到25 nm,而当使用摩尔分数为2.5%的PEG-脂质时,肝细胞沉默的佳粒径大小是78 nm。由于PEG-脂质的烷基尾部有14个碳,它不能稳定地固定在LNP表面,随着可电离脂质MC3和DSPC的脱落,它逐渐在循环中从LNP上脱落。这种PEG脱落被认为在一定程度上使LNP转染有效,但如果脱落过强,会导致可电离脂质和DSPC的迅速丧失,这将对内涵体逃逸产生不利的影响。
例如,通过将烷基尾部延伸到18个碳,PEG-脂质不会脱落,但在肝细胞中也没有被沉默。另一方面,加入较高浓度的PEG使颗粒变得更小,会导致更快的脱落、可电离脂质丢失、并且减少沉默基因效果。目前,人们对LNP的不稳定和动态性质不完全了解。另一项研究(与上面提到的研究类似)还发现,用1.5%的PEG-脂质制备的中等直径64 nm的LNP比更大直径(100 nm)的LNP(0.5%PEG脂质)以及更小直径(48 nm)LNP(3%PEG脂质)能更有效地递送mRNA。
然而,通过改变四种脂质的摩尔比,在1.5%PEG-脂质、直径64 nm的LNP中,以保持计算出的LNP PEG层下的DSPC密度为佳值,这样能够制备更大尺寸的的(100 nm)LNP,其mRNA表达与64 nm的LNP相比增加了两倍。因此,除了LNP的pKa、可电离脂质的分子形状和PEG-脂质的动力学之外,更详细的LNP超微结构特征和每个组分的状态也决定了其效价。
内涵体逃逸
对siRNA-LNPs的细胞摄取和内涵体转运进行了详细的研究,并假设其与mRNA LNPs的细胞摄取和内涵体转运相似。一项使用电子显微镜中金溶胶粒子计数的定量研究表明,对于MC3 LNP,内涵体中只有2%的siRNA从内涵体逃逸到胞浆中,导致每个细胞中有几千个siRNA分子可供沉默。
然而,这个数字与在**相关浓度下每个细胞RISC与有功能活性的siRNA的相互作用估计水平的范围相同。因此,绝大多数siRNA注定要进行溶酶体降解或通过多囊体(晚期内涵体)循环在体外进行释放。增加LNPs的内涵体逃逸是提高给药效率的主要途径,主要是通过调节LNP的pKa和增加可电离脂质的锥形形态来实现的。
对于后者,脂质H和脂质5含有三个分支,而在MC3中只有两个分支,但具有相似的PKA,与MC3相比,它们的内涵体逃逸率变为原来的四倍。目前还没有报道Acuitas ALC-0315的内涵体逃逸情况,但Acuitas ALC-0315的肝细胞沉默效率是MC3的10倍,这表明其更具有锥形的四分支结构也有更强的内涵体逃逸。
因此,这些新一代的可电离脂质似乎实现了内涵体逃逸率,与MC3 siRNA-LNPs的2-5%相比,接近15%或更高。这一领域的挑战之一是缺乏可广实施的可靠、标准化的内涵体逃逸方法。目前已经开发了许多方法,但通常只针对一个实验室组。*近还发现,mRNA发生胞吐的量与释放到胞浆中的量相似。MC3 LNPs在MC3的晚期内涵体和NP1复合体中被解离,MC3LNPs和mRNA被重新包裹成外泌体,并从细胞中输出。这些内-外泌体与*初的MC3 LNPs具有相似的mRNA递送能力,但内-外泌体可以运输到不同的组织,且似乎免疫**能力较低。LNPs携带的mRNA的外泌体重新分布的潜在意义仍有待探索。
电荷和配体介导的靶向
使用**带电的阳离子脂质的早期脂质纳米颗粒很大,由于它们的**带正电荷,很快就被**,并且他们通常是以肺部为靶点。BioNTech的研究小组减少了DOTMA/Dope mRNA LNPs中阳离子DOTMA的数量,直到由于NP比小于1的阴离子mRNA过量而导致净电荷带负电。
静脉注射这些带负电荷的且长度为300 nm的mRNA LNPs可以导致脾脏靶向和树突状细胞的mRNA表达,它们能够介导适应性和I型干扰素介导的先天免疫机制用于**免疫**。同样,用C12-200原型LNP生产脾靶向的mRNA LNP,但用小的、树枝状的可电离脂质Cf-Deg-Lin代替C12-200,Cf-Deg-Lin具有四个亚油酸烷基链和四个氮原子,TNS pKa为5.7。LNP的这种极低的pKa将确保可电离脂质在pH低于7之前不被质子化,从而制备出一种包载带负电荷的mRNA的LNP,直到内涵体途径晚期,并输送到脾脏。
他们发现脾脏中表达mRNA的主要细胞群是B淋巴细胞,根据流式细胞术分析,其中7%的B淋巴细胞表达mRNA。*近,利用三种不同的碱性(MC3、C12-200或5A2-SC8)作为可电离脂质,混合在一定摩尔分数的**性阳离子脂质(DOTAP)或**性阴离子脂质(18PA)中,使LNPs具有净正电荷、净负电荷或净中性电荷,从而实现了荷电靶向。与上述发现一致的是,