

| 组分 | 含量(0.5 mL/支) | 作用 | |
| 抗原 | 水痘带状疱疹病毒糖蛋白 E(gE) | 50 μg | 特异性抗原 |
| 佐剂 | 皂树皂苷 QS-21 | 50 μg | 免疫刺激剂 |
| 3-O-去酰基-4』-单磷酰脂 A(MPL) | 50 μg | 免疫刺激剂 | |
| 二油酰基磷脂酰胆碱(DOPC) | 1 mg | 构成脂质双分子膜,包裹 | |
| 胆固醇 | 0.25 mg | 减毒,调节脂质体流动性 | |
| 其它 | 蔗糖、Tween80、磷酸钠、磷酸氢钾、氯化钠、注射用水 | ||
| 年龄 | SHINGRIX | 安慰剂组 | 有效性 (95% CI) | ||||
| N | n | 每千人-年发病率 | N | n | 每千人-年发病率 | ||
| 整体 (≥ 50)c | 7,344 | 6 | 0.3 | 7,415 | 210 | 9.1 |
97.2 (93.7, 99.0) |
| 50-59 | 3,492 | 3 | 0.3 | 3,525 | 87 | 7.8 |
96.6 (89.6, 99.3) |
| 60-69 | 2,141 | 2 | 0.3 | 2,166 | 75 | 10.8 |
97.4 (90.1, 99.7) |
| ≥ 70 | 1,711 | 1 | 0.2 | 1,724 | 48 | 9.4 |
97.9 (87.9, 100.0) |
| 年龄 | SHINGRIX | 安慰剂组 | 有效性 (95% CI) | ||||
| N | n | 每千人-年发病率 | N | n | 每千人-年发病率 | ||
| 整体(≥ 70)c | 6,541 | 23 | 0.9 | 6,622 | 223 | 9.2 |
89.8 (84.3, 93.7) |
| 70-79 | 5,114 | 17 | 0.9 | 5,189 | 169 | 8.8 |
90.0 (83.5, 94.3) |
| ≥ 80 | 1,427 | 6 | 1.2 | 1,433 | 54 | 11.0 |
89.1 (74.7, 96.2) |
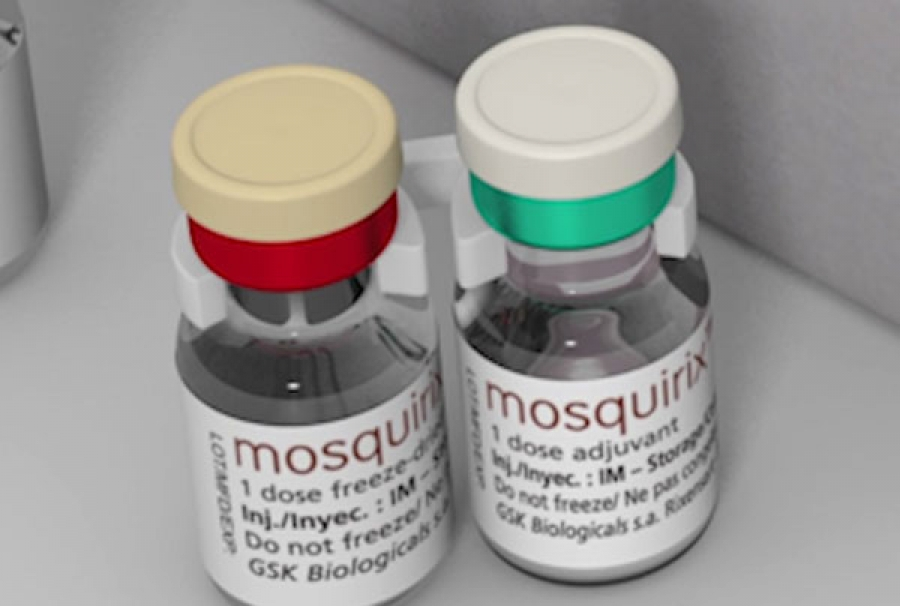
| 适应症及人群: | Mosquirix 是一种疫苗,用于 6 周至 17 个月的儿童,以帮助预防由寄生虫恶性疟原虫引起的疟疾。Mosquirix 还有助于防止肝脏感染乙型肝炎病毒,但是不能预防由乙型肝炎病毒以外的其他病毒引起的肝炎。 |
| 给药方式及剂量: | Mosquirix 注射到大腿肌肉或肩部周围的肌肉(三角肌)中。孩子接受三次注射,每次注射间隔一个月。建议在第三次注射后 18 个月进行第四次注射。该药只能通过处方获得。一剂为 0.5 mL。不要在血管内、皮内或皮下注射疫苗 |
| 剂型剂规格: | 注射用混悬剂(粉剂+混悬剂)(抗原:重组蛋白;佐剂:AS01E),单剂量为 0.5 mL |
| 禁忌症: | 对疫苗中活性物质或列出的赋形剂过敏,对之前接种过敏或乙肝疫苗过敏人群慎用 |
| 身体中的影响部位 | 频率 | 不良反应 |
| 代谢系统 |
|
食欲下降 |
| 精神影响 | 很常见的烦躁 |
|
| 神经系统影响 | 常见的 | 嗜睡 |
| 罕见 | 高热惊厥(接种 7 天内) | |
| 胃肠道疾病 | 常见 | 腹泻 |
| 罕见 | 呕吐 | |
| 注射部位 | 很常见 | 发烧、注射部位反应(肿胀、红斑、疼痛) |
| 罕见 | 注射部位硬结 |
| 组分 | 含量(0.5 mL/剂) | |
| 抗原 | 部分恶性疟原虫环子孢子蛋白与乙型肝炎表面抗原 (RTS) 融合,并与乙型肝炎表面抗原 (S) 结合(RTS,S) | 25 μg |
| 佐剂 | 皂树皂苷 QS-21 | 25 μg |
| 3-O-去酰基-4』-单磷酰脂 A(MPL) | 25 μg | |
| 其他 |
抗原瓶:蔗糖、Tween80、膦 S 二钠二水合物、磷酸二氢钠 佐剂瓶:二油酰磷脂酰胆碱(DOPC)、胆固醇、氯化钠、无水膦 S 二钠、磷酸二氢钾、注射用水 |
|
|
|
疫苗对所有临床疟疾感染的预防 | 疫苗对所有临床疟疾感染重症的预防 | 疫苗对所有临床疟疾感染住院的预防 |
| >12 月的随访(第三剂开始,N = 6003) | 33%(26;39) | 37%(5;58) | 32%(7;50) |
| >18 月的随访(第三剂开始,N = 6003) | 27%(20;32) | 15%(-20;39) | 17%(-7;36) |
| 3 剂(ATP 队列;N = 5997) | |||
| >30 月的随访(从第 3 剂开始) | 20%(13;27) | 11%(-22;35) | 10%(-15;30) |
| >36 月的随访(从第 3 剂开始) | 18%(11;25) | 13%(-17;35) | 13%(-9;31) |
| 3 剂+第 4 剂(ATP 队列;N = 5997) | |||
| >30 月的随访(从第 3 剂开始) | 28%(22;34) | 17%(-14;40) | 25%(3;42) |
| >36 月的随访(从第 3 剂开始) | 27%(21;32) | 21%(-7;42) | 27%(7;43) |
|
|
疫苗对所有临床疟疾感染的预防 | 疫苗对所有临床疟疾感染重症的预防 | 疫苗对所有临床疟疾感染住院的预防 |
| >12 月的随访(第三剂开始,N = 6880) | 51%(47;55) | 45%(22;60) | 48%(35;59) |
| >18 月的随访(第三剂开始,N = 6885) | 46%(42;49) | 36%(15;51) | 42%(29;52) |
| 3 剂(ATP 队列;N = 6918) | |||
| >30 月的随访(从第 3 剂开始) | 34%(29;39) | 2%(-28;25) | 18%(1;32) |
| >46 月的随访(从第 3 剂开始) | 26%(21;31) | -6%(-35;17) | 12%(-5;26) |
| 3 剂+第 4 剂(ATP 队列;N = 6918) | |||
| >30 月的随访(从第 3 剂开始) | 46%(42;50) | 32%(10;50) | 40%(26;52) |
| >46 月的随访(从第 3 剂开始) | 39%(34;43) | 29%(6;46) | 37%(24;49) |
|
|
疫苗对所有临床疟疾感染的预防 | 疫苗对所有临床疟疾感染重症的预防 |
| 首次给药时年龄为 6-12 周的婴儿(ITT 队列,N = 1905) | ||
| 3 剂 | 13%(4;21) | 34%(9;53) |
| 3 剂+第 4 剂 | 16%(7;24) | 31%(5;50) |
| 首次给药时年龄为 5-17 月的儿童(ITT 队列,N = 2512) | ||
| 3 剂 | 19%(11;27) | 10%(-18;32) |
| 3 剂+第 4 剂 | 24%(16;31) | 37%(15;53) |
|
|
anti-CS antibody GMC | ||
|
|
one month after the third dose (month 3) (95% CI) | before the fourth dose (month 20) (95% CI) | one month after the fourth dose (month 21) (95% CI) |
| 婴儿(6-12周首次给药) | N=1221 | N=530 | N=503 |
|
211 EU/mL (198;224) |
6 EU/mL (5;7) |
170 EU/mL (154;188) |
|
| 儿童(5-17个月首次给药) | N=1034 | N=442 | N=402 |
|
621 EU/mL (592;652) |
34 EU/mL (31;39) |
318 EU/mL (295;343) |
|

| 获批时间: | 2022年7月13日(FDA-EUA);2021年12月20日(EMA) |
| 适应症及人群: | Nuvaxovid?于主动免疫,主要用于预防12岁及以上个体由SARS-CoV-2引起的 COVID-19。 |
| 给药方式及剂量: | 肌肉注射,建议在第一剂注射后三周接种第二剂(每剂0.5mL) |
| 剂型剂规格: |
多剂量小瓶,一瓶5mL(包含10剂) 一剂(0.5mL)含有5 μg 刺突蛋白-S蛋白,并含有佐剂Matrix-M(组分-A:42.5 μg;组分-C:7.5 μg) |
| 不良反应: |
最常?的不良反应是注射部位压痛(75%)、注射部位疼痛 (62%)、疲劳 (53%)、肌痛 (51%)、头痛 (50%)、不适 (41%)、关节痛 (24%) 和恶?或呕吐 (15%) .不良反应的严重程度通常为轻度?中度,局部事件的中位持续时间?于或等于 2 天,接种后全?事件的中位持续时间?于或等于 1 天。 总体??,年轻组的不良反应发?率较?:注射部位压痛、注射部位疼痛、疲劳、肌痛、头痛、全?乏力、关节痛和恶?或呕吐的发?率在18岁?65岁以下的成年?中较?年?65岁及以上的?。 |
| 禁忌症: | 不要给任何对疫苗的任何成分有严重过敏反应(例如,过敏反应)史的人接种。 |
| 组分 | 含量(0.5mL/剂) | |
| 抗原 | SARS-CoV-2刺突蛋白 | 5 μg |
| 佐剂 | 皂苷提取物A | 42.5 μg |
| 皂苷提取物C | 7.5 μg | |
| 其他 |
七水磷酸氢二钠、磷酸二氢钠一水合物、氯化钠、Tween80、氢氧化NA(pH)、盐酸(pH)、注射用水 Matrix-M:胆固醇、磷脂酰胆碱(包含生育酚)、磷酸二氢钾、氯化Jia、磷酸氢二钠二水合物、氯化钠、注射用水 |
|
| 反应部位 | 非常常见(≥1/10) | 常见(1/100≤X<1/10) | 不常见(1/1000≤X<1/100) |
| 血液及淋巴 |
|
|
淋巴结 |
| 神经系统 | 头痛 |
|
|
| 血管疾病 |
|
|
高血压 |
| 胃肠道疾病 | 恶心或呕吐 |
|
|
| 皮肤及皮下组织 |
|
|
皮疹、红斑、瘙痒、荨麻疹 |
| 肌肉骨骼和结缔组织 | 肌肉疼痛、关节痛 |
|
|
| 注射部位及全身反应 |
注射部位按压疼痛 注射部位疼痛 疲劳 |
注射部位发红 注射部位肿胀 发热 发冷 四肢疼痛 |
注射部位瘙痒 |
| 分组 | Nuvaxovid | 安慰剂组 | 疫苗功效(95%,置信区间) | ||||
| 参与者 |
COVID-19感染病例 n(%) |
发病率(每千人每年) | 参与者 |
COVID-19感染病例 n(%) |
发病率(每千人每年) | ||
| 主要疗效终点 | |||||||
| 所有参与者 | 17312 | 14(0.1) | 3.26 | 8140 | 63(0.8) | 34.01 | 90.4%(82.9,94.6) |
| 分组 | Nuvaxovid | 安慰剂组 | 疫苗功效(95%,置信区间) | ||||
| 参与者 |
COVID-19感染病例 n(%) |
发病率(每千人每年) | 参与者 |
COVID-19感染病例 n(%) |
发病率(每千人每年) | ||
| 主要疗效终点 | |||||||
| 所有参与者 | 7020 | 10(0.1) | 6.53 | 7019 | 96(1.4) | 63.43 | 89.7%(80.2,94.6) |
| 主要疗效终点 | |||||||
| 18-64岁 | 5067 | 9(0.2) | 12.30 | 5062 | 87(1.7) | 120.22 | 89.8%(79.7,94.9) |
| 65-84岁 | 1953 | 1(0.10) |
|
1957 | 9(0.9) |
|
88.9%(20.2,99.7) |