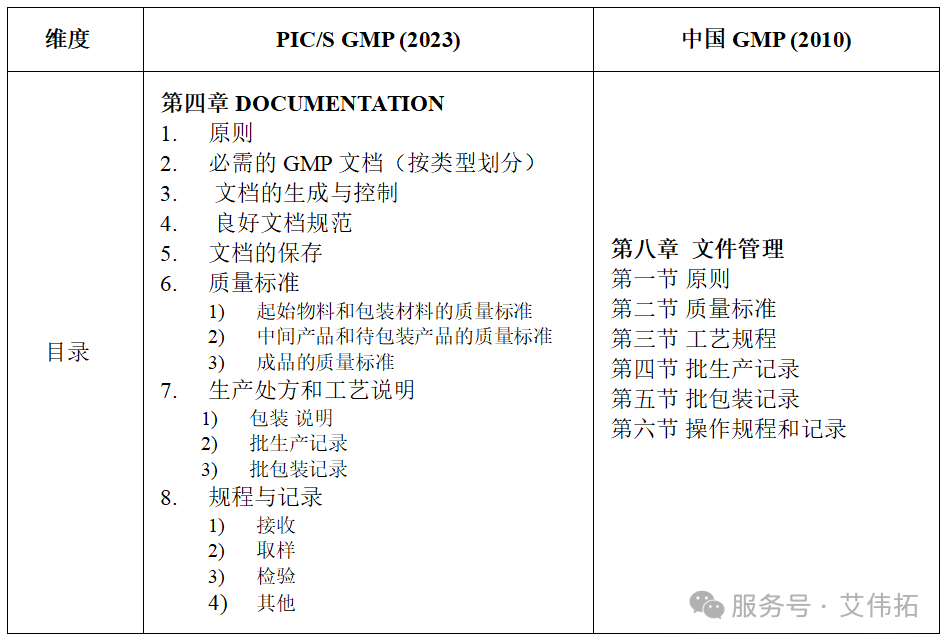
文件管理是质量保证系统的基本要素,为影响药品质量的活动提供了可追溯、可验证的书面证据。PIC/S GMP第四章与中国GMP第八章均对文件管理提出了详尽要求。两者在基本原则和核心要求上高度一致,覆盖范围基本包括质量标准、工艺规程/说明、批记录、操作规程和记录等。
质量标准
两者均明确要求为物料、成品应当有经批准的质量标准,其要求包含的核心内容基本一致。对中间产品,两者都规定,在中间产品被外购/外销或其质量评价与成品质量直接相关时,应当制定其质量标准。在效期管理方面,PIC/S GMP默认物料通常设定“the maximum period of storage before re-examination”。中国GMP则为物料提供了有效期和复验期两种选项。
工艺规程
每种产品的每个生产批量均应当有经企业批准的工艺规程。生产处方均要求明确产品信息、物料清单和产量说明。生产操作说明都涵盖生产场所、设备、步骤、控制和贮存。包装操作要求两者均涵盖包装规格/形式、包装材料清单、印刷包材样稿、清场要求、操作步骤描述等基本要素。
批生产记录
两者GMP均强调批生产记录必须基于现行批准的工艺文件,两者关键内容绝大部分是重合的。中国 GMP 的规定更为全面和细致,它不仅规定了记录应包含的内容(中国GMP第一百七十五条),还延伸至记录本身,例如要求“避免填写差错”,批生产记录的每一页应当标注产品的名称、规格和批号(第一百七十二条);原版空白记录需经生产和质量负责人共同批准,且每批产品的生产只能发放一份原版空白批生产记录的复制件(第一百七十三条)。
批包装记录
中国GMP 第五节 批包装记录总结了包装环节的文档管理要求。它规定每批产品包装均需建立可追溯的批包装记录(第一百七十六条),记录需依据工艺规程制定(第一百七十七条),内容涵盖产品信息、包装材料、包装操作、物料平衡检查及异常处理等内容(第一百八十条)。包装操作需实时记录并由操作人员签字确认(第一百七十九条)。PIC/S 批包装记录内容与中国GMP总体相似,其条款4.21 (h),所有印刷包装材料及待包装产品的名称、代码,以及发放、使用、销毁或退库的数量等,均应记录以便进行充分核对。若包装过程中已实施可靠的电子控制措施,则可能需要不包含此信息的理由。
操作规程和记录
中国GMP仅三条内容(第一百八十一条至第一百八十三条),规定了操作规程应包含的要素,并要求对厂房、设备、物料、文件和记录等实施唯一性编码,同时对确认、验证、偏差处理等关键活动也需建立相应规程并记录。PIC/S GMP补充了物料接收、取样、检验等环节更细致的记录要求。
参考依据:
【1】 PIC/S: Guide to GMP for Medicinal Products part Ⅰ (PE 009-17, August 2023) Ⅰ部
【2】 《药品生产质量管理规范(2010年修订)》