原料药发生变更,应该如何评估原料药的变更对制剂的影响,最基本的关注点是什么,CDE近期发布的《〈已上市化学药品药学变更研究技术指导原则(试行)〉原料药变更的问答》(征求意见稿)进行了详细清晰的解答。
为什么CDE要专门出一个这样的问答呢,原因是关于原料的变更对制剂来说需要进行的研究工作,一般还是比较复杂,涉及到的情形也较多,制剂企业缺乏一个基本的评估原则。在《已上市化学药品药学变更研究技术指导原则(试行)》中虽有涉及,但也只是阐述了原料药供应商的变更,并且原料药供应商的变更还有前提:即原料药的关键理化性质要前后一致,因此其他类型原料药的变更及如果供应商变更原料药前后不一致的情形,制剂需进行哪些研究工作,指导原则未能明确,本次问答解决了这些问题。
问答中,将原料药变更大致分为两种情形:
一种是原料药上市后变更,一种是原料药供应商变更,在问答中将原料药供应商变更涉及到的前后不一致的情形进行了细化和解答。本问答使得制剂在遇到原料药变更中的各种情形时如何进行评估提供了科学可行的方向,使得长期困扰制剂企业的问题得到了官方部门提供的详细的答案,进一步促进了制剂企业长期科学可行的实践药品的全生命周期管理。
一、原料药上市后变更,制剂需要进行哪些研究工作?
(一)制剂持有人应结合原料药的变更情况,评估原料药变更前后的一致性。
1. 杂质谱的一致性
杂质谱的一致性是指:
①新增杂质未高于《化学药物杂质研究的技术指导原则》及 ICH Q3A等规定的鉴定限度;
②已有杂质(包含立体异构体)及杂质总量均在质量标准规定的限度内,如标准中无规定,应在原工艺生产的多批产品测定范围内;
③新使用的溶剂残留量符合《化学药物有机溶剂残留量研究的技术指导原则》及 ICH Q3C等的有关规定;
④新的元素杂质符合《化学药物杂质研究的技术指导原则》及ICH Q3D等的有关要求。
⑤应参考 ICH M7对致突变杂质进行考察,必要时进行控制。
2. 关键理化性质的一致性
原料药关键理化性质的一致性主要指晶型和粒度等的一致性。当原料药的理化性质可能影响制剂的性能(如溶出曲线、稳定性、生物利用度等)和生产过程
的可行性(如混合均匀性、流动性、可压性等)时,应特别关注原料药变更前后理化性质的一致性。
(二)原料药生产工艺、注册标准、生产场地、包材及供应商变更,制剂需要进行哪些工作?
根据第一条,评估变更研究工作的原则就是评估原料药变更前后两个方面的一致性,根据评估结果判断需要进行的研究工作。
原料药前后评估一致时,评估制剂属于微小变更,评估不一致时,为中等或重大变更。
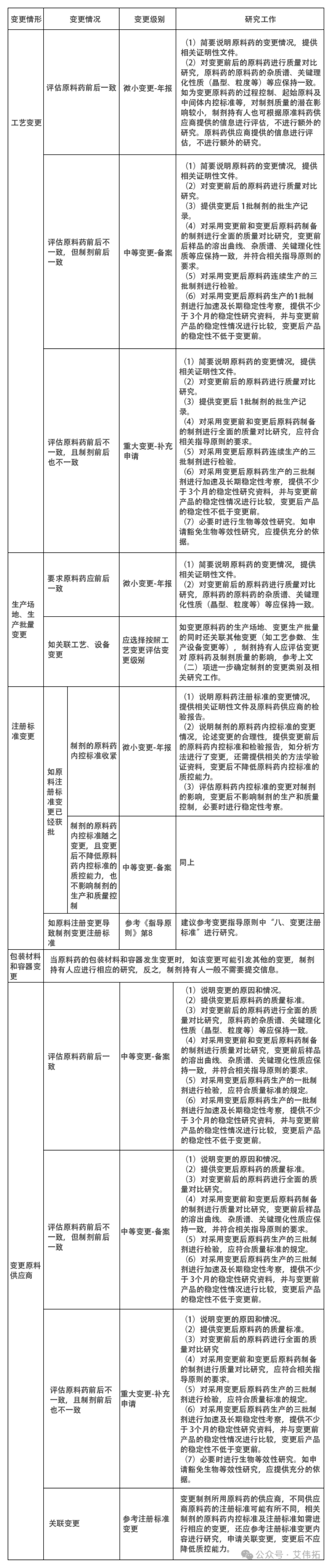
根据以上变更评估可以看出,原料药供应商变更同样的变更情况夏对于制剂的风险要高于同一原料药的变更,制剂需要提交的变更级别更高,需要进行的研究工作也会更多。
